Novice
Krvni pripravki
05.07.2019
Danes velikokrat slišimo ali beremo o uporabi krvnih pripravkov pri kirurških posegih. Ponujajo nam plazmo bogato z rastnimi faktorji (PRGF), plazmo bogato s trombociti (PRP), fibrin obogaten s trombociti… S pomočjo teh pripravkov naj bi skrajšali čas celjenja ran po kirurških posegih ter zmanjšali možnost komplikacij, vseeno pa se zdi, da se strokovni argumanti mešajo s komercialnimi interesi in nekomu, ki se prvič sreča s temi produkti, se ni lahko prebiti skozi obilo literature in reklamnega materiala, tudi zaradi dejstva, ker na tem področju še vedno vlada zmeda v klasifikaciji produktov.
Predvsem v maksilofacialni in oralni kirurgiji, estetski kirurgiji in v športni medicini se v zadnjem desetletju popularizira uporaba koncentratov trombocitov kot avtolognih ekstraktov, ki se jih prenese na operirano področje ali obolelo mesto z namenom, da se izboljša oziroma pospeši celjenje.
Že leta 1970 so se v kirurgiji pojavila fibrinska lepila – šlo je za koncetriran fibrinogen, polimerizacija pa je bila inducirana s trombinom in kalcijem. (1) Izdelava fibrinskih lepil je bila drag in zapleten postopek, predvsem, če se je želelo pridobiti avtologni produkt, ko je bilo potrebno pacientom odvzeti kri nekaj dni pred načrtovano porabo fibrinskega lepila. V nasprotnem primeru se je uporabljalo produkte, ki so bili izdelani iz donorskse krvi iz krioprecipitatov. Prva uporaba trombocitnih pripravkov v maksilofacialni in oralni krurgiji je bila opisana leta 1997(2) in nato leto dni kasneje(3). Slednji članek je zanimiv predvsem zato, ker poleg tega, da omenja PRP (platelet rich plasma), opisuje tudi rastne faktorje kot pomemben člen pripravkov iz krvi. Sledilo je obdobje preučevanja različnih rastnih faktorjev, ki se sproščajo iz trombocitov. Zgodovina preučevanja krvnih pripravkov namreč kaže, da je to potekalo v treh fazah in v vsaki fazi se je (skoraj izključno) preučevalo eno od treh komponent bioloških tkiv: matriks, bioaktivne faktorje in celice. Fibrinski matriks je končni produkt koagulacijske kaskade in prvo tkivo v fazi celjenja in kot tak seveda izredno zanimiv kot adhezivni biomaterial. V 80 letih prejšnjega stoletja se je fibrinskemu matriksu vedno bolj dodajalo tudi trombocite in s takšnimi pripravki so preiskovalci imeli pozitivne rezultate v okulistiki, nevrokirurgiji, splošni kirurgiji... Trombociti so se dodajali, da se je povečala čvrstost pripravkov fibrisnkih mrež in da so dosegli večjo mehansko tesnenje v tkivih. O vlogi trombocitov pri celjenju tkiv in sproščanju rastnih faktorjev se ni govorilo. Dandanes pa je v študijah največ poudarka na celični vsebini pripravkov iz krvi. Na veliko se preučuje vloga levkocitov in trombocitov tako pri sintezi rastnih faktorjev in njihovem sproščanju, kot pri njihovi vlogi v procesu celjenja, regulaciji vnetja in kontroliranju okužbe. Pri vseh treh komponentah teh pripravkov pa gre za zelo zapleten medsebojni vpliv, ki še vedno ni povsem pojasnjen. Počasi se je trombocitom pripisovalo vedno večji pomen pri celjenju tkiv, celo večji kot fibrinu. V zadnjih letih se vedno večja vloga pripisuje tudi vključevanju levkocitov v te pripravke. Levkociti se namreč vključujejo v regulacijo sproščanja rastnih faktorjev iz trombocitov, ob temu pa imajo pomembno vlogo pri regulaciji vnetnega odgovora in kontroli okužb.
Zaradi vse večjega števila komercialnih pripravkov iz krvi se je v zadnjih letih pojavila potreba po klasifikaciji teh izdelkov(4). Že po definiciji vsi ti pripravki vsebujejo koncentrirane trombocite s številnimi pripadajočimi rastnimi faktorji. Ena od klasifikacij razdeli te pripravke tako v štiri skupine glede na vsebnost levkocitov in strukturo fibrina v njih.
- P-PRP (pure platelet rich plasma)
- L-PRP (leukocyte platelet rich plasma)
Gre za tekoče suspenzije plazme bogate z rastnimi faktorji, z ali brez levkocitov. Postopek pridobivanja teh pripravkov je nekoliko bolj zapleten, kajti potem, ko se odvzame venska periferna kri, se ta z dodatkom citrata centrifugira po določenem protokolu, da nastanejo tri frakcije (slika 1). Spodnji sloj so eritrociti, ki se zavržejo. Zgornji sloj je plazma brez celic in ta sloj je potrebno s posebno pipeto odstraniti, nato pa z drugo pipeto postopoma plast za plastjo zajeti srednji sloj, v katerem so rastni faktorji. Meja med tema dvema slojema ni povsem jasna. Srednji sloj se nato lahko uporabi v tekoči obliki ali pa se ga v drugih epruvetah aktivira z dodatkom kalcijevega klorida in po polimerizaciji nastane nežen fibrinski gel (PRGF ali plasma/preparation rich in growth factors), ki pa ni stabilen in ga je potrebno uporabiti hitro. Po protokolu, ki ga je opisal Eduardo Anitua (izdelek se prodaja kot Endoret –prgf, firma BTI) (5) je za izdelavo P-PRP je potrebno srednji sloj ločiti tudi od frakcije levkocitov, ki so tik nad frakcijo eritrocitov, vendar je tudi ta meja precej nejasna. Po mnenju avtorja naj bi levkociti sprožali vnetno reakcijo in so kot takšni nezaželeni v končnem izdelku.
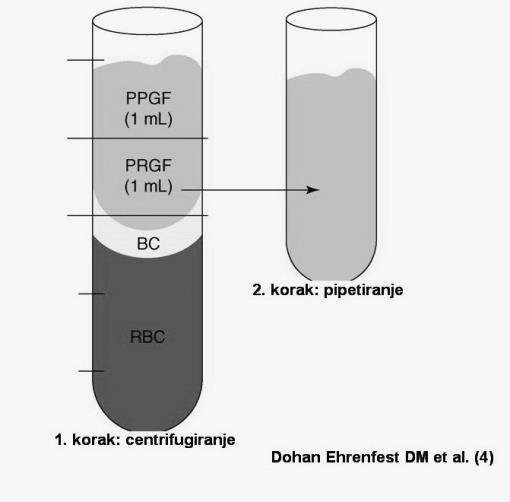 Slika 1. Protokol za izdelavo PRGF. Kri z dodatkom citrata (antikoagulanta) se centrifugira (8 minut na 460 obratov/min) in razdeli v tri sloje. Spodaj so eritrociti (RBC), vmes je sloj motne barve (buffy coat), v katerem so v glavnem levkociti, nad njim pa je sloj plazme brez celic. Ta sloj je empirično razdeljen na sloj brez rastnih faktorjev (PPGF, plasma poor in growth factors) in sloj plazme bogate z rastnimi faktorji (plasma rich in growth factors). PPGF se odstrani s posebnimi pipetami, PRGF pa se z drugimi posebnimi pipetami zbere v posebne posodice, ki se jim lahko doda kalcijev klorid za aktivacijo strjevanja. (4)
Slika 1. Protokol za izdelavo PRGF. Kri z dodatkom citrata (antikoagulanta) se centrifugira (8 minut na 460 obratov/min) in razdeli v tri sloje. Spodaj so eritrociti (RBC), vmes je sloj motne barve (buffy coat), v katerem so v glavnem levkociti, nad njim pa je sloj plazme brez celic. Ta sloj je empirično razdeljen na sloj brez rastnih faktorjev (PPGF, plasma poor in growth factors) in sloj plazme bogate z rastnimi faktorji (plasma rich in growth factors). PPGF se odstrani s posebnimi pipetami, PRGF pa se z drugimi posebnimi pipetami zbere v posebne posodice, ki se jim lahko doda kalcijev klorid za aktivacijo strjevanja. (4)
- P-PRF (pure platelet rich fibrin)
- L-PRF (leukocyte platelet rich fibrin)
Pri preparatih PRF gre za čvrst fibrinski biomaterial z ali brez levkocitov. Obstajajo samo v aktivirani obliki in so povsem naravni, brez dodatkov za aktivacijo. Polimerizacija fibrina poteka naravno in je del pripravljalnega postoka. Choukroun (6) je prvi opisal protokol za izdelavo fibrina bogatega s trombociti (PRF, platelet rich fibrin). Odvzame se periferna venska kri in se nato v posebnih epruvetah brez dodanega antikoagulanta centrifugira, zaradi česar se takoj začne proces koagulacije in fibrinske polimerizacije. Ker gre za popolnoma naraven proces, se preparat pogosto omenja kot druga generacija trombocitnih pripravkov. Po centrifugiranju nastanejo trije sloji v epruvetah (slika 2). Spodnji z eritrociti se zavrže. Uporabi se srednji sloj, ki predstavlja fibrinski čep. Gre za močan fibrinski matriks s kompleksno tridimenzionalno strukturo v katero so ujeti trombociti in levkociti. Če takšen čep nežno stisnemo med dva sloja, nastane relativno močna membrana, ki se nato uporablja za različne namene. Uporabna je nekaj ur, dokler je med dvema slojema kovine in se ne suši.
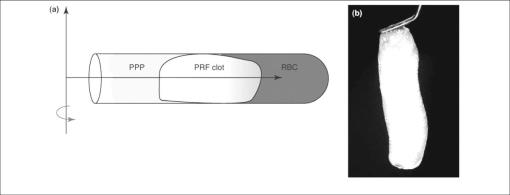 Slika 2. Po protokolu po Choukrounu se kri takoj po odvzemu centrifugira (14 minut, 1500 obr/min) brez antikoagulantov in koagulacija se hitro začne. Kri se razdeli v tri sloje. Zgornji je plazma brez trombocitov (PPP, platelet poor plasma), v spodnjem pa so eritrociti (RBC). Srednji sloj je čvrst in v njemu so ujeti trombociti in levkociti skupaj s proteini kot so rastni faktorji in fibronektin (4).
Slika 2. Po protokolu po Choukrounu se kri takoj po odvzemu centrifugira (14 minut, 1500 obr/min) brez antikoagulantov in koagulacija se hitro začne. Kri se razdeli v tri sloje. Zgornji je plazma brez trombocitov (PPP, platelet poor plasma), v spodnjem pa so eritrociti (RBC). Srednji sloj je čvrst in v njemu so ujeti trombociti in levkociti skupaj s proteini kot so rastni faktorji in fibronektin (4).
Omenjena izdelka (prvi, ki ga je opisal Anitua in drugi, ki ga je opisal Choukrun) se največkrat uporabljata pri ambulantnem delu v oralni in maksilofacialni kirurgiji, v estetski medicini in v športni medicini (7) . Med njima je kar nekaj razlik. Omenili smo že, da levkociti v PRGF protokolu niso zaželeni, nasprotno pa se v protokolu za izdelavo L-PRF-a smatra, da so levkociti koristni. Tako fibrinska struktura v končnem izdelku kot vsebnost levkocitov odločilno vplivata na sproščanje rastnih faktorjev, koagulacijskih faktorjev in beljakovin v matriksu iz fibrinskega gela. Študije (8) so pokazale, da membrana, ki jo dobimo po protokolu za P-PRP (PRGF) hitro razpade. V in-vitro poskusih je bila L-PRF membrana po 7 dneh še intaktna, medtem ko je P-PRP (PRGF) membrana razpadla po treh dneh. Že nekaj prejšnjih študij je pokazalo, da PRF membrana v eksperimentalnih pogojih lahko obdrži obliko do tri tedne. Zaradi čvrste strukture fibrinskega čepa v PRF membranah torej prihaja do postopnega in dolgotrajnega sproščanja rastnih faktorjev. Tudi zato, ker so v PRF membranah celice (levkociti in trombociti), medtem ko so PRGF membrane pretežno acelularne. V primeru PRF membran gre torej za naravni živi biomaterial, ki lahko postopno sprošča rastne faktorje, medtem ko gre v primeru PRGF membran za sproščanje rastnih faktorjev in beljakovin, ki so se ujeli v fibrinsko mrežo ob aktivaciji in degranulaciji trombocitov. Te študije ne kažejo na to, da se pri regeneraciji tkiv in njihovem celjenju PRGF izdelek slabše odreže od PRF izdelka. Pomembno pa je vedeti, da se izdelka razlikujeta tako po mehanskih kot bioloških značilnostih in sta uporabna v različnih kliničnih situacijah. V grobem lahko rečemo, da se P-PRP produkti (kot PRGF) bolje odrežejo tam, ko potrebujemo izdelek v tekoči obliki za injiciranje (estetska kirurgija, športna medicina), medtem ko je L-PRF izdelek bolj primeren v primerih, ko potrebujemo bioaktivni in čvrst biomaterial (slika3). S PRF membranami tako v implantologiji precej učinkovito učvrstimo dodani kostni nadomestek na mestu dograjene kosti, zelo učinkovito prekrijemo membrano sinusa in zapremo potencialne razpoke na njej. Če material primešamo kostnemu granulatu, dobimo mešanico, ki jo je lažje oblikovati in obdrži obliko. Koliko celice, proteini in rastni faktorji v membranah pripomorejo k boljšemu in morda hitrejšemu celjenju, bo pokazal čas in prihodnje študije, zaenkrat pa so rezultati razpoložljivih študij zelo vzpodbudni.
 Slika 3. Iz vsake epruvete dobimo čvrsto fibrinsko mrežo, ki jo nato med dvema slojema stisnemo v čvrste membrane, ki jih je mogoče tudi šivati na tkiva. V dnu posode se nabere tekočina, ki tudi vsebuje celice, proteine in rastne faktorje in se jo uporabi za mešanje s kostnimi nadomestki in kolagenskimi membranami.
Slika 3. Iz vsake epruvete dobimo čvrsto fibrinsko mrežo, ki jo nato med dvema slojema stisnemo v čvrste membrane, ki jih je mogoče tudi šivati na tkiva. V dnu posode se nabere tekočina, ki tudi vsebuje celice, proteine in rastne faktorje in se jo uporabi za mešanje s kostnimi nadomestki in kolagenskimi membranami.
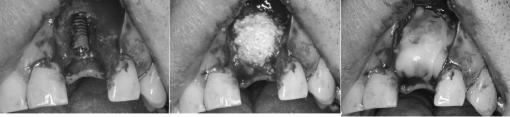 Slika 4. Kostni nadomestek (ksenograft) premešamo s tekočino, ki se nabere po stiskanju PRF matriksa v membrane, da dobimo zmes, ki lažje zadrži obliko. S PRF membranami prekrijemo presadek. Kadar je poškodovan oziroma prerezan periost, preko PRF membran namestimo tudi kolagenske resorbilne mebrane.
Slika 4. Kostni nadomestek (ksenograft) premešamo s tekočino, ki se nabere po stiskanju PRF matriksa v membrane, da dobimo zmes, ki lažje zadrži obliko. S PRF membranami prekrijemo presadek. Kadar je poškodovan oziroma prerezan periost, preko PRF membran namestimo tudi kolagenske resorbilne mebrane.
David Dovšak
Dentalni kirurški estetski D center
david@d-center.si
LITERATURA:
- M. H, Die Wirkungen verschiedener Fibrinpraparate auf Kontinuitat-strennungen der Rattenhaut. Osterr Z Stomatol 67, 338-359 (1970).
- D. H. Whitman, R. L. Berry, D. M. Green, Platelet gel: an autologous alternative to fibrin glue with applications in oral and maxillofacial surgery. J Oral Maxillofac Surg 55, 1294-1299 (1997).
- R. E. Marx et al., Platelet-rich plasma: Growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 85, 638-646 (1998).
- D. M. Dohan Ehrenfest, L. Rasmusson, T. Albrektsson, Classification of platelet concentrates: from pure platelet-rich plasma (P-PRP) to leucocyte- and platelet-rich fibrin (L-PRF). Trends Biotechnol 27, 158-167 (2009).
- E. Anitua, Plasma rich in growth factors: preliminary results of use in the preparation of future sites for implants. Int J Oral Maxillofac Implants 14, 529-535 (1999).
- A. F. Choukroun J, Schoeffler C, Vervelle A, Une opportunité en paro-implantologie: le PRF. Implantodontie 42, 55-62 (2001).
- D. M. Dohan Ehrenfest et al., Classification of platelet concentrates (Platelet-Rich Plasma-PRP, Platelet-Rich Fibrin-PRF) for topical and infiltrative use in orthopedic and sports medicine: current consensus, clinical implications and perspectives. Muscles Ligaments Tendons J 4, 3-9 (2014).
- G. M. d. P. D.M. Dohan Ehrenfest, P. Doglioli, et al., Slow release of growth factors and thrombospondin-1 in Choukroun's platelet-rich fibrin (PRF): A gold standard to achieve for all surgical platelet concentrates technologies. Growth Factors 27, 63-69 (2009).